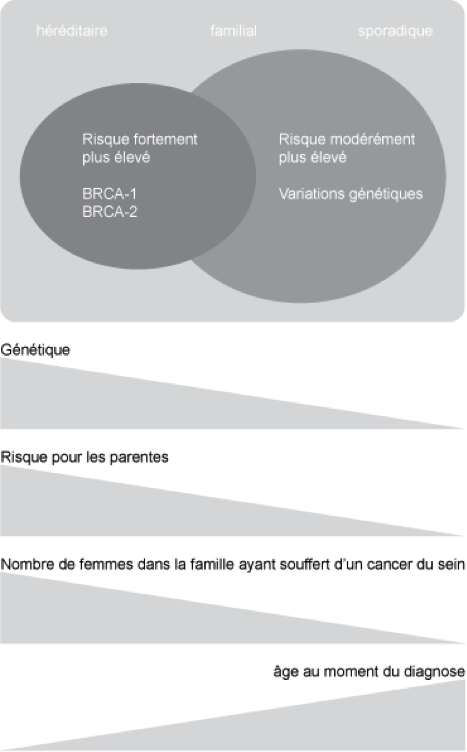
Une illustration
Se faisant des soucis, Els veut consulter un médecin parce que plusieurs personnes de sa famille ont développé un cancer du sein (fig. 9.2). Elle a 27 ans et n’a jamais souffert d’un cancer du sein. Lors de la consultation, un arbre généalogique est établi, indiquant qu’un grand nombre de parents du côté paternel ont été touchés par le cancer du sein: sa tante Linda a eu un cancer du sein à l’âge de 38 ans et sa grand-mère est décédée de cette affection à 42 ans. Les deux sœurs aînées de sa grand-mère ont également été victimes d’un cancer du sein. La doyenne l’a développé à 65 ans alors que la cadette a souffert d’un cancer du sein bilatéral, la première fois à 45 ans, puis à l’âge de 51 ans. Deux des cinq cousines du père d’Els ont également eu un cancer du sein à un jeune âge.
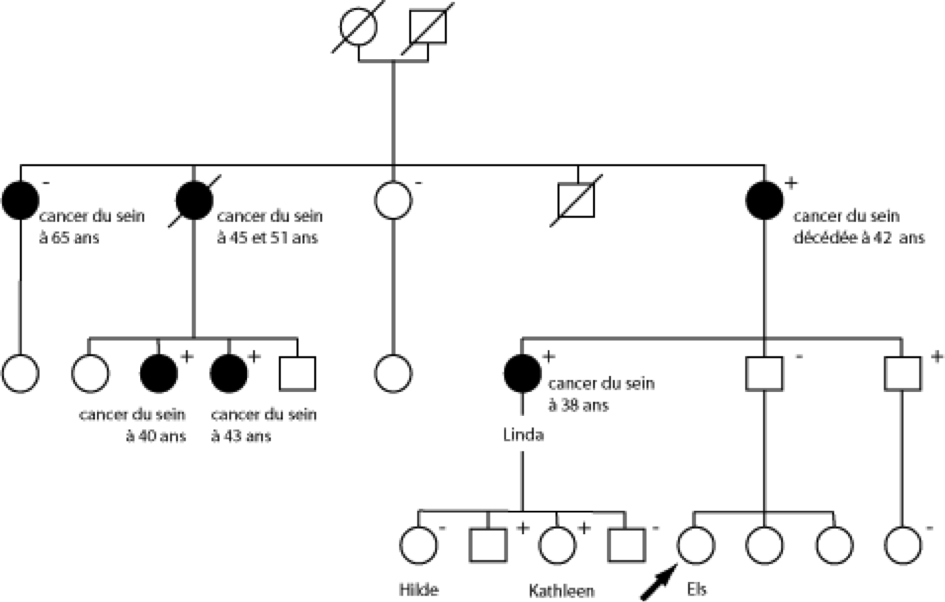
Fig. 5.2. Arbre généalogique représentatif d’une famille ayant une prédisposition héréditaire au cancer du sein. Pour des raisons d’anonymat et de confidentialité, il s’agit d’un exemple fictif basé sur l’expérience de notre pratique clinique. Les parents masculins sont représentés par un carré, tandis que les parentes féminines sont indiquées par des cercles. Les symboles des femmes qui ont développé un cancer de l’ovaire ou du sein sont noirs. Les personnes décédées sont indiquées au moyen d’un trait diagonal traversant leur symbole. Dans cette famille, beaucoup de parents de différentes générations ont eu un cancer du sein à un jeune âge: il y a donc de grandes chances que l’hérédité joue un rôle prépondérant dans le développement d’un cancer du sein chez ces femmes. Pour ce qui est de Linda, une anomalie génétique a été constatée sur le gène BRCA1. Un examen a démontré que d’autres parents possèdent également cette mutation (indiquée au moyen d’un «+»), chez des femmes ayant déjà eu un cancer du sein (analyse diagnostique) et chez des personnes non touchées (examen pré-symptomatique), tant chez des hommes que chez des femmes. Quelques parents semblaient ne pas être concernés par la mutation (indiqués au moyen d’un «-»). La sœur aînée de la mère de Linda a développé un cancer du sein à l’âge de 65 ans, mais elle n’était pas porteuse de la mutation du gène BRCA1. Elle représente donc ce qu’on appelle la phénocopie.
Els apprend lors de la consultation qu’il y a de grandes chances que l’hérédité joue un rôle dans l’apparition du cancer du sein dans sa famille et qu’une analyse génétique semble très utile. Elle s’étonne toutefois qu’on ne procède pas tout de suite à une prise de sang. Le médecin lui explique que les analyses génétiques s’effectuent en premier lieu sur les personnes ayant déjà développé un cancer du sein, parce que celles-ci sont le plus susceptibles de porter une mutation. Els avait déjà parlé à sa tante Linda de cette analyse génétique et sa tante a eu une réaction très positive. Elle décide donc avec sa tante Linda de fixer un rendez-vous à la policlinique génétique, de sorte que l’analyse génétique puisse être menée chez Linda.
Une fois à la policlinique, Linda reçoit d’amples informations concernant le comment et le pourquoi de l’analyse génétique et on se penche également sur ses motifs. Elle avait déjà envisagé elle-même de sauter le pas, mais quand sa nièce Els le lui a demandé, elle s’est définitivement décidée. Elle en parle également de façon ouverte à ses enfants. Elle se fait toutefois des soucis pour les possibles conséquences d’un résultat défavorable. Elle s’inquiète surtout pour ses enfants, qui peuvent eux aussi avoir hérité de la prédisposition. Il ressort en outre de l’entretien que sa fille aînée, Hilde, vient de surmonter une lourde dépression, de sorte qu’un examen génétique mené sur elle n’est pas si évident.
Avant de procéder à la prise de sang, Linda signe un formulaire dans lequel elle déclare avoir obtenu suffisamment d’information au sujet du contenu de l’analyse et des implications des résultats possibles. Elle est étonnée que l’analyse prendra six mois, mais elle comprend pourquoi quand le médecin lui explique l’analyse moléculaire.
Six mois plus tard, Linda reçoit une lettre lui disant que l’analyse est terminée et la convoquant à une consultation afin de discuter du résultat. Elle décide d’y aller avec sa nièce Els. Tout comme elle l’attendait, le médecin lui indique qu’une mutation du gène BRCA1 a été trouvée. Linda avait discuté de cette possibilité avec son oncologue et avait déjà décidé de se faire enlever préventivement les ovaires si elle était effectivement porteuse. Une amputation préventive de la poitrine lui inspire trop de crainte, bien qu’elle continue à avoir peur de développer une nouvelle tumeur mammaire. Elle opte pour un bon suivi médical de ses seins afin de réduire le risque le plus possible.
Els, quant à elle, suppose qu’on lui fera immédiatement une prise de sang afin de procéder à une analyse génétique. En effet, on peut maintenant vérifier si elle est également porteuse de la mutation. Malgré cela le médecin lui indique qu’il vaudrait mieux analyser son père d’abord, puisqu’il y a une probabilité de 50% qu’il soit porteur. S’il n’a pas hérité de la mutation, il n’est pas nécessaire d’analyser ses enfants. Els est un peu déçue, mais la possibilité que son père ne soit pas porteur constitue pour elle une pensée réconfortante. Elle est également contente du fait que l’analyse de son père prendra beaucoup moins de temps: maintenant que la mutation du gène BRCA1 a été dépistée, on peut plus rapidement vérifier si quelqu’un est porteur ou non. Après environ quatre semaines, sont père peut déjà aller à la consultation afin de discuter du résultat. Au grand soulagement d’Els, il s’avère qu’il n’est pas porteur. Cela implique que ni elle, ni ses sœurs, ne peuvent avoir hérité de la mutation du gène BRCA1. Leur risque de cancer du sein n’est donc pas plus élevé que celui des autres femmes du même âge. Els décide de participer au dépistage normal du cancer du sein par mammographie à partir de ses 50 ans.
Hilde, la fille aînée de Linda, ne sait pas si elle veut participer à l’analyse. Elle craint de ne pas être à même de supporter un résultat négatif et décide d’attendre. Kathleen, la fille cadette de Linda, veut en revanche bénéficier de l’analyse. Elle fixe un rendez-vous à la policlinique et y reçoit des explications sur les différents aspects de l’analyse. Elle y a également un entretien avec un psychologue. Ils parlent des motifs de sa décision et de l’influence possible du résultat sur sa vie ultérieure. Kathleen lui indique qu’elle se fera amputer la poitrine en guise de prévention si elle est porteuse. Elle ne souhaite pas faire enlever ses ovaires parce qu’elle se considère encore trop jeune. Elle se fait plus de souci pour le risque de cancer du sein: elle a vécu de près la maladie de sa mère, quand elle subissait une chimiothérapie, et elle veut éviter cela à tout prix. Ses futurs enfants jouent également un rôle important dans sa décision: elle veut toujours être là pour eux et souhaite donc réduire au maximum le risque d’une maladie. Après quatre semaines, Kathleen se dirige à nouveau vers la policlinique afin de discuter du résultat. L’analyse a démontré qu’elle a hérité de la mutation de sa mère. Après une première phase de vives émotions, elle reprend courage et puise sa force dans le fait qu’elle sait où elle en est. Elle trouve également rassurant qu’elle puisse toujours s’adresser au médecin et au psychologue de la policlinique pour des informations médicales supplémentaires ou si le résultat s’avère plus difficile à assumer que prévu.
Les mois suivants, on parle beaucoup de la possibilité de bénéficier d’une analyse génétique dans la famille. Certains ne souhaitent pas participer, tandis que d’autres - tant des hommes que des femmes - veulent se rassurer et fixent un rendez-vous. Hilde décide finalement aussi de se faire analyser. Il ressort de l’analyse qu’elle n’est pas porteuse. Elle est très rassurée, mais se sent quand même un peu coupable par rapport à sa sœur.



 Céline Zorn, sage-femme, coach de vie et praticienne en hypnose allie ses différents domaines d’expertise et son expérience ...
Céline Zorn, sage-femme, coach de vie et praticienne en hypnose allie ses différents domaines d’expertise et son expérience ... Move your breast est un gala de soutien qui a pour but de mettre en lumière les conséquences du cancer du sein sur le corps de la femme et sur sa féminité au sens large...
Move your breast est un gala de soutien qui a pour but de mettre en lumière les conséquences du cancer du sein sur le corps de la femme et sur sa féminité au sens large... Voilà trois semaines que nous sommes rentrées, c'était formidable et nous avons profité chaque instant de cette magnifique aventure.
Voilà trois semaines que nous sommes rentrées, c'était formidable et nous avons profité chaque instant de cette magnifique aventure. Venus médical s’engage dans le processus de reconstruction mammaire. L’esthétique est terriblement importante ...
Venus médical s’engage dans le processus de reconstruction mammaire. L’esthétique est terriblement importante ... Soutenez notre association avec le verre BABC de l'amitié
Soutenez notre association avec le verre BABC de l'amitié